

发布时间 : 21-10-27

近日,深圳中山妇产医院生殖医学临床研究中心团队在期刊《Frontiers in Immunology》(IF:7.561)发表题为“Granulocyte-macrophage colony stimulating factor in single blastocyst conditioned medium as a biomarker for predicting implantation outcome of embryo”的研究型论文,率先利用超微量蛋白检测技术,实现了对单个胚胎培养液中粒细胞-巨噬细胞集落刺激因子(GM-CSF)的定量检测。结果表明,培养基中GM-CSF的浓度与优质胚胎率、临床妊娠率和继续妊娠率均显著相关,GM-CSF联合形态学评分比单用形态学评分对妊娠结局预测具有更高的临床价值。
研究背景
在辅助生殖治疗过程中,能否挑选出最具种植潜能的胚胎进行移植,是决定能否成功妊娠的关键。目前,临床上对胚胎种植潜能的评估主要依据胚胎形态学评分。形态学评分操作简单,使用方便,但形态学评分好的胚胎并不意味着具有较好的种植潜能,有学者就曾在文章里指出“胚胎的外表可能会欺骗我们”【1】。因此,形态学评分评估胚胎种植潜能存在一定的局限性,发展一种能够更加准确预测胚胎种植潜能的方法是十分必要的。
胚胎生长发育过程中可以分泌多种因子,有些分泌因子可以作用于自身,促进自身发育,另有一些因子可以作用于子宫内膜,介导胚胎着床过程中的母胎对话【2】。因此,检测这些分泌蛋白理论上可以评估胚胎相关功能是否健全,进而从功能学角度评估胚胎种植潜能。
GM-CSF是一种造血细胞因子。在胚胎发育过程中,GM-CSF可以上调抗凋亡因子Bcl-2的表达,促进胚胎对葡萄糖摄取,在应激反应和细胞凋亡过程中对胚胎起到保护作用【3】。同时,GM-CSF还在维持生殖免疫微环境【4】,调控胎盘形态和功能方面起到关键作用【5】。有研究表明,胚胎在发育过程能够分泌GM-CSF【6】,胚胎分泌的GM-CSF可能与胚胎发育及着床相关功能密切相关。因此,培养液中胚胎分泌的GM-CSF可能是预测胚胎种植潜能的潜在生物标志物。
在临床上,胚胎培养在30 μl左右的培养液中,且胚胎分泌的GM-CSF浓度极低,常规检测方法无法对其定量检测,这导致胚胎分泌的GM-CSF与种植潜能的关系尚不明确。
研究结果
胚胎培养液中GM-CSF的定量检测
本研究中,研究人员使用先进的单分子蛋白检测技术实现了单个胚胎培养液中GM-CSF的定量检测。结果表明,胚胎培养液中GM-CSF的浓度极低,平均每mL培养液中GM-CSF含量仅为几飞克(10-15克/ml)。
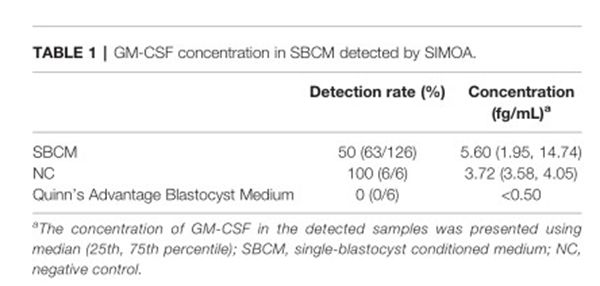
GM-CSF浓度与妊娠结局的关系
研究人员依据GM-CSF浓度将样本分为高浓度组、中浓度组和低浓度组,比较3组样本患者年龄、BMI、不孕年限等基础条件以及妊娠结局。结果显示,3组样本患者的基础条件无显著差异,但3组的HCG阳性率、临床妊娠率以及继续妊娠率均存在显著差异,其中高浓度组的妊娠结局最优,GM-CSF浓度与妊娠结局存在正相关。
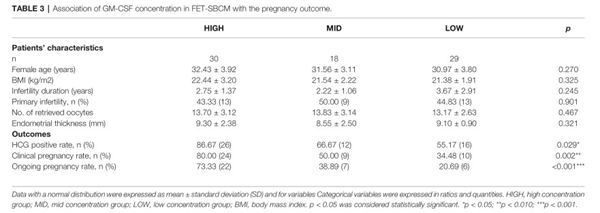
GM-CSF对妊娠结局的预测价值
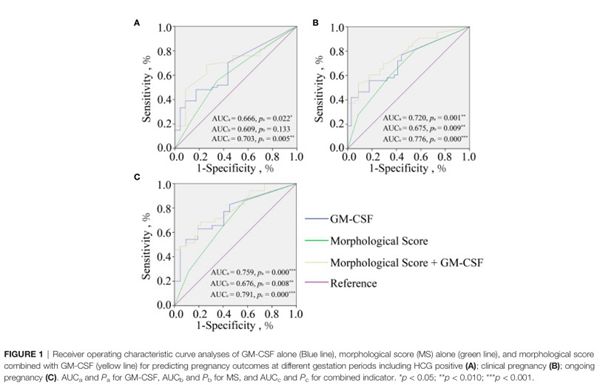
尽管GM-CSF与妊娠结局存在正相关,但GM-CSF是否能够作为一种生物标志物,评估胚胎种植潜能呢?为回答该问题,研究人员进行了ROC分析,比较了形态学评分、GM-CSF浓度以及形态学评分结合GM-CSF浓度预测妊娠结局的曲线下面积,结果显示相较于形态学评分,GM-CSF预测HCG阳性率、临床妊娠率及继续妊娠率均有更大的曲线下面积,而GM-CSF结合形态学评分预测各妊娠结局的曲线下面积最大。这说明,相较于形态学评分,GM-CSF可以更好的预测胚胎种植潜能,而GM-CSF浓度结合形态学评分预测的准确性更高。因此,GM-CSF有望成为预测胚胎种植潜能的生物标志物。
总结
本研究率先利用单分子蛋白检测技术,实现了对胚胎培养液中GM-CSF的定量检测,使进一步评估GM-CSF浓度与妊娠结局之间的关系成为可能;然后根据胚胎培养液的GM-CSF浓度将患者分成高、中、低三组,通过比较不同组的妊娠结局,发现高浓度组的妊娠结局最优,证明了GM-CSF浓度与妊娠结局呈正相关;最后,利用ROC分析,评估形态学评分、GM-CSF浓度、GM-CSF浓度结合形态学评分这三种方案预测妊娠结局的准确性,分析结果表明GM-CSF浓度结合形态学评分预测妊娠结局的曲线下面积最大,精确性更高。
本研究对于未来的临床应用提出了一个可能性:针对采用辅助生殖技术的患者,通过检测胚胎培养液中GM-CSF浓度结合形态学或其他检测指标,选择出最优质的胚胎进行移植,有望获得最佳的妊娠结局。为此,科研团队正在继续攻关,争取让研究成果早日应用于临床检测!
本研究得到了国家自然科学基金、科技部重点研发计划、深圳市医疗卫生“三名工程”项目及深圳市基础研究学科布局项目支持。
参考文献
【1】Montag M, Toth B, Strowitzki T. New Approaches to Embryo Selection. Reprod BioMed Online (2013) 27(5):539–46. doi: 10.1016/j.rbmo.2013.05.013
【2】 Thouas G, Dominguez F, Green M, Vilella F, Simon C, Gardner D. Soluble Ligands and Their Receptors in Human Embryo Development and Implantation. Endocr Rev (2015) 36(1):92–130. doi: 10.1210/er.2014-1046
【3】 Behr B, Mooney S, Wen Y, Polan ML, Wang H. Preliminary Experience With Low Concentration of Granulocyte-Macrophage Colony-Stimulating Factor: A Potential Regulator in Preimplantation Mouse Embryo Development and Apoptosis. J Assist Reprod Gen (2005) 22(1):25–32. doi: 10.1007/s10815-005-0817-9
【4】Robertson S, O’Connell A, Hudson S, Seamark R. Granulocyte-Macrophage Colony-Stimulating Factor (GM-CSF) Targets Myeloid Leukocytes in the Uterus During the Post-Mating Inflammatory Response in Mice. J Reprod Immunol (2000) 46(2):131–54. doi: 10.1016/S0165-0378(99)00060-1
【5】Bowen J, Chamley L, Mitchell M, Keelan J. Cytokines of the Placenta and Extra-Placental Membranes: Biosynthesis, Secretion and Roles in Establishment of Pregnancy in Women. Placenta (2002) 23(4):239–56. doi:10.1053/plac.2001.0781
【6】Kazuhiro K, Yuan C, Yimin S, Yuan C, Jie Q, Barry B, et al. Promotion of Human Early Embryonic Development and Blastocyst Outgrowth In Vitro Using Autocrine/Paracrine Growth Factors. PloS One (2012) 7(11):e49328. doi: 10.1371/journal.pone.0049328